Tính chất liên kết của bất kỳ một nguyên tử hoặc ion nào chủ yếu được xác định bởi số lượng electron hóa trị của nó. Các electron hoá trị là những electron không tạo nên lớp vỏ electron bên trong. Thay vào đó, Chúng tạo nên lớp vỏ electron bên ngoài.
Định nghĩa: Electron hóa trị
Các electron hóa trị là các electron tạo thành lớp vỏ ngoài cùng của nguyên tử.
Các electron hóa trị là các electron s và p ở lớp vỏ ngoài cùng. Các electron hiện diện ở lớp vỏ bên trong là các electron lõi. Khi chúng ta nghiên cứu và quan sát nguyên tử của một nguyên tố, chúng ta bắt gặp các hạt hạ nguyên tử cực nhỏ gọi là các electron hóa trị. Cấu trúc Lewis giúp chúng ta theo dõi các điện tử hóa trị và dự đoán các loại liên kết.
Các electron hóa trị đều được sắp xếp trong các quỹ đạo hoặc lớp vỏ khác nhau và hầu hết là các hạt mang điện tích âm. Hơn nữa, các electron này chịu trách nhiệm cho sự tương tác giữa các nguyên tử và sự hình thành các liên kết hóa học.
Tuy nhiên, không phải tất cả các electron đều liên kết với nguyên tử. Chỉ các electron có ở lớp vỏ ngoài cùng của một nguyên tố mới có thể tham gia vào các phản ứng liên kết hóa học hoặc phân tử. Loại electron như vậy được gọi là electron hóa trị.
Hoá trị là gì?
Hóa trị là số lượng electron mà một nguyên tử phải mất đi hoặc nhận được để đạt được cấu hình điện tử của khí hiếm hoặc khí trơ gần nhất. “Các electron ở lớp vỏ ngoài không được lấp đầy gọi là các electron hóa trị”.
Electron hoá trị dùng làm gì?
Các electron hóa trị là một phần của các phản ứng hóa học vì chúng chứa nhiều năng lượng hơn so với các electron có trong các quỹ đạo bên trong. Trong khi đó, số lượng điện tử hóa trị có mặt cũng giúp chúng ta xác định tính chất hóa học của một nguyên tố cụ thể, chẳng hạn như hóa trị hoặc hóa trị của nó, sự hình thành liên kết với các nguyên tố khác.
Nó cũng cho chúng ta ý tưởng về việc các nguyên tử có thể hình thành liên kết dễ dàng như thế nào, số lượng electron chưa ghép cặp và bao nhiêu nguyên tử có thể tham gia.

Chúng ta có thể thấy rằng lithium chỉ có tổng cộng 3 electron và kali có 19e. Natri có tổng số electron là 11e. Hình vẽ cho thấy các nguyên tử nguyên tố nhóm 1 có tổng số electron khác nhau, nhưng chúng đều có cùng số điện tử hóa trị vì chúng đều có 1 electron lớp ngoài cùng.
Đặc điểm của electron hóa trị
Các electron tham gia vào liên kết hóa học và phản ứng của nguyên tử. Nó được cho là chiếm quỹ đạo trong một nguyên tử. Số lượng electron hóa trị của một nguyên tử có thể được lấy từ bảng tuần hoàn vì nó bằng số nhóm của nguyên tử. Các nguyên tử ổn định nhất nếu chúng có lớp vỏ hóa trị chứa đầy các electron. Các nguyên tử chuyển giao hoặc chia sẻ các electron theo cách mà chúng có thể đạt được một lớp vỏ đầy electron.
Một số đặc điểm chính của một electron hóa trị là;
- Đối với các nguyên tố nhóm chính, electron hóa trị chỉ tồn tại ở lớp electron ngoài cùng.
- Một electron hóa trị có thể tồn tại ở lớp vỏ bên trong của kim loại chuyển tiếp .
- Một nguyên tử bao gồm một lớp vỏ kín của các e hóa trị thường sẽ trơ về mặt hóa học.
- Một điện tử hóa trị có thể hấp thụ hoặc giải phóng năng lượng dưới dạng photon.
- Các điện tử hóa trị cũng xác định tính dẫn điện của một nguyên tố. Tùy thuộc vào bản chất của các nguyên tố có thể là kim loại, phi kim loại hoặc á kim.
Cách xác định electron hóa trị
Một trong những cách dễ nhất để tìm các electron hóa trị là kiểm tra vị trí của các nguyên tố trong bảng tuần hoàn. Các điện tử hóa trị của một nguyên tố có thể được tìm thấy bằng cách kiểm tra kỹ cột dọc trong đó các nguyên tố được nhóm lại. Bằng cách nhìn vào số nhóm được cung cấp, chúng ta có thể xác định số lượng electron hóa trị mà một nguyên tố được liệt kê dưới cột cụ thể đó có.
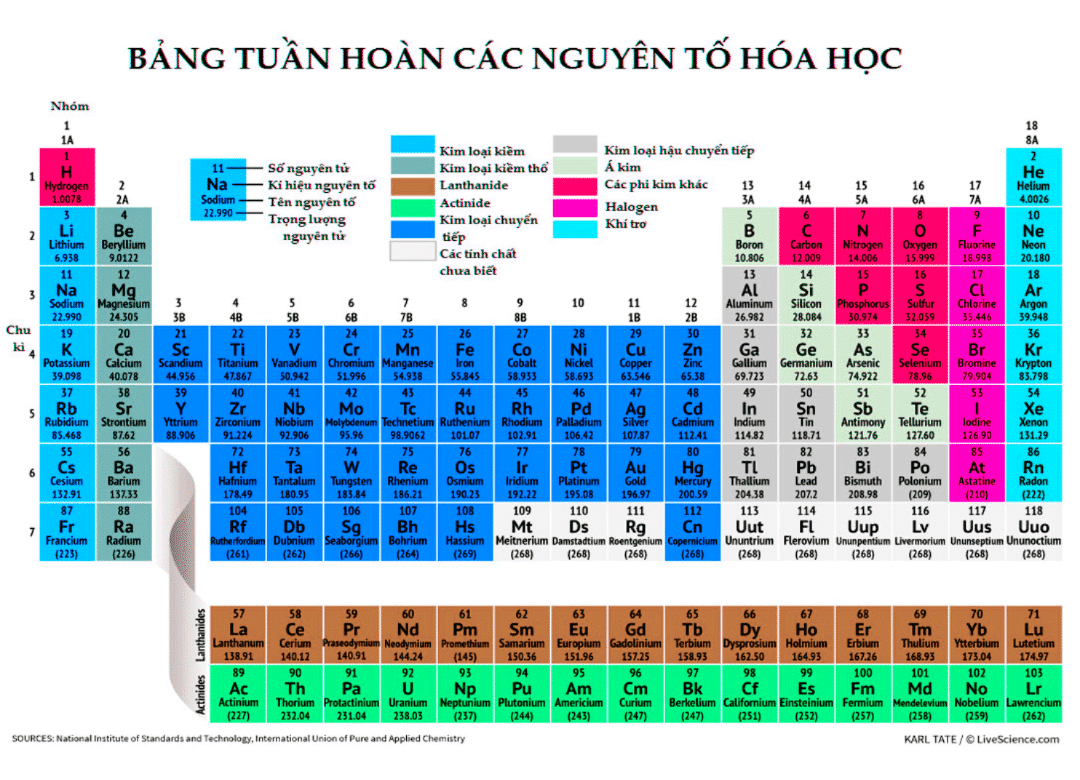
Một cách khác để tìm hoặc xác định các electron hóa trị là biết cấu hình electron.
Tuy nhiên, nếu lấy các kim loại chuyển tiếp (nhóm 3-12) thì việc tìm điện tử hóa trị khá phức tạp. Cấu trúc nguyên tử của các nguyên tố này cứng nhắc và lớp con d không hoàn thiện và nằm thấp hơn lớp vỏ bên ngoài.
Electron hóa trị của các nguyên tố
Dưới đây là danh sách số lượng electron hóa trị có trong các nhóm khác nhau.
Nhóm bảng tuần hoàn Electron hóa trị Kim loại kiềm - Nhóm 1 (I) 1 Kim loại kiềm thổ - Nhóm 2 (II) 2 Nhóm Bo - Nhóm 13 (III) 3 Nhóm cacbon - Nhóm 14 (IV) 4 Nhóm nitơ - Nhóm 15 (V) 5 Nhóm oxy - Nhóm 16 (VI) 6 Halogen - Nhóm 17 (VII) 7 Khí hiếm - Nhóm 18 (VIII hoặc 0) 8

