
Zn + H2SO4 | Cân bằng phản ứng Zn + H2SO4 → ZnSO4 + H2
Zn+H2SO4 là một phản ứng hóa học quan trọng và được sử dụng rộng rãi trong các ứng dụng công nghiệp, thí nghiệm. Phản ứng này không chỉ cung cấp thông tin quan trọng về tính chất của các chất hóa học mà còn có những ứng dụng đáng kể trong sản xuất và nghiên cứu. Cùng Toppy tìm hiểu quá trình Zn+H2SO4 có thể mang lại nhiều lợi ích cho sự phát triển bền vững và tiến bộ của con người nhé.
Lý thuyết về Zn+H2SO4
Phương trình Zn tác dụng H2SO4 loãng
Zn + H2SO4 → ZnSO4 + H2
Điều kiện phản ứng xảy ra phan ứng Zn tác dụng H2SO4 loãng
Nhiệt độ thường, H2SO4 loãng
Tính chất hóa học của H2SO4 loãng
Làm đổi màu quỳ tím thành đỏ
Axit sunfuric loãng tác dụng với kim loại
Axit sunfuric loãng có khả năng tác dụng với kim loại đứng trước hidro trong dãy hoạt động hóa học của kim loại
Tác dụng với kim loại (Al, Fe, Zn, Mg,…) → muối sunfat + khí hidro
Ví dụ:
Fe + H2SO4 (loãng) → FeSO4 + H2
Mg + H2SO4 → MgSO4 + H2
Axit sunfuric loãng tác dụng với bazơ
Tác dụng với bazơ → muối sunfat + nước
Thí dụ:
H2SO4 + Fe(OH)2 → FeSO4 + 2H2O
2NaOH + H2SO4 → Na2SO4 + 2H2O
Axit sunfuric loãng tác dụng với oxit bazơ
Tác dụng với oxit bazơ → muối sunfat + nước
Ví dụ:
BaO + H2SO4 → BaSO4 + H2O
H2SO4 + MgO → MgSO4 + H2O
H2SO4 + CuO → CuSO4 + H2O
Axit sunfuric loãng tác dụng với muối
Tác dụng với muối → muối (mới) + axit (mới)
BaCl2 + H2SO4 → BaSO4 + HCl
H2SO4 + Na2CO3 → Na2SO4 + CO2 + H2O
Nội dung mở rộng Zn+H2SO4
Axit Sunfuric là gì? (H2SO4)
Axit sunfuric là gì đang gặp nhiều thắc mắc ở nhiều người chưa tìm hiểu về nó. Và câu giải đáp đó là một axit có công thức là H2SO4. Nó tồn tại dưới dạng axit sunfuric loãng không màu, không mùi, không bay hơi. H2SO4 nặng hơn nước và có khả năng hòa tan nước ở bất kỳ tỷ lệ nào. Đây là một loại axit được xem là cực mạnh và được sử dụng chủ yếu trong các ngành công nghiệp, hay dùng làm chất xúc tác cho các phản ứng hóa học.
Bạn có thể thuận lợi tìm kiếm được mẫu axit này ở bất kỳ nơi đâu. Mà dễ thấy và dễ nhận diện nhất là trong nước mưa. Nếu như bạn dính nước mưa và cảm thấy rát, khó chịu thì đấy là do tác dụng của axit sunfuric.
Hiện giờ, chưa có một nhà chuyên gia khoa học nào kiếm được loại H2S04 ở dạng tinh khiết trên địa cầu này mà nó chỉ ở dưới dạng chất lỏng có chứa đa dạng các chất khác nhau. Vì thế mà H2SO4 dạng tính khiết chỉ được điều chế từ những chất hóa học phản ứng với nhau tạo thành.

Axit sunfuric là gì?
Tính chất của H2SO4 dung dịch axit sunfuric
Axit sunfuric được chia ra làm hai dạng, đó là axit sunfuric loãng và axit sunfuric đặc. Mỗi loại axit sẽ có những thuộc tính vật lý và tính chất hóa học hoàn toàn khác nhau.
Tính chất vật lý của H2SO4
Như đã giới thiệu ở trên, H2SO4 đặc hay loãng đều có điểm chung chỉ tồn tại dưới dạng chất lỏng, không màu, không mùi và không vị.
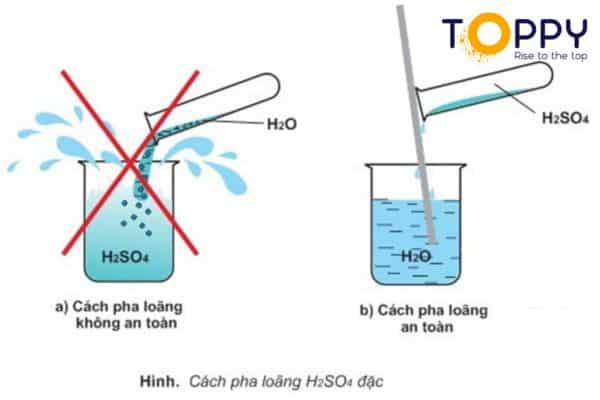
Axit sunfuric có đặc tính là khó bay hơi và tan trong nước. Còn axit sunfuric đặc vượt trội với khả năng hút nước rất mạnh và tỏa đa dạng nhiệt. Thành ra bạn chú ý không nên cho nước vào axit mà chỉ được phép cho axit vào nước. Để đánh trường hợp bị bỏng xảy ra lúc nước tác dụng với axit. Và H2SO4 có thể pha loãng ra để trở thành axit sunfuric loãng. Nhưng bạn nhớ thực hiện đúng trật tự ở trên để không gặp những tình trạng nguy hiểm.
Tính chất hóa học của H2SO4
Đối với H2SO4 loãng (axit sunfuric loãng)
Đây là một loại axit có đặc tính hết sức mạnh nên có đầy đủ những thuộc tính hóa học của một loại axit thường nhật. Điển hình như:
- Khiến cho màu quỳ tím chuyển sang đỏ
- Phản ứng với những kim loại, bazơ, oxitbazơ, muối để có thể tạo ra những chất hóa học như mong muốn.
Đối với H2SO4 đặc (axit sunfuric đặc)
Axit sunfuric đặc có các tính chất hóa học tương tự như axit sunfuric loãng. Bên cạnh đó, còn một số đặc biệt riêng của cái axit này đấy là:
- Lúc tác dụng với kim loại, thêm đồng (Cu) vào thì dung dịch sẽ tạo ra màu xanh
- H2SO4 đặc còn có thuộc tính háo nước rất mạnh. Thí dụ như đưa H2SO4 đổ vào chén đường trắng thì chỉ sau vài phút sau sẽ chuyển thành màu đen và phun trào.
Các dạng axit sunfuric (H2SO4)
Axit sunfuric được sử dụng với các mục đích khác nhau do vậy sẽ tồn tại ở những dạng khác nhau có thể nói tới như là:
- Axit sunfuric loãng sử dụng trong phòng thí nghiệm thường chỉ có 10%
- Sử dụng cho bình ắc quy khoảng 33,5%
- Hàm lượng 62,18% là axit được sử dụng để sản xuất phân bón
- 77,67% được sử dụng trong tháp sản xuất hay axit glover
- 98% là axit đậm đặc
Ứng dụng của H2SO4
Trong sản xuất công nghiệp
Axit sunfuric H2SO4 có mặt trong phần lớn các đơn vị ngành công nghiệp như: luyện kim, phẩm nhuộm, chất tẩy rửa, giấy, sợi. Theo ước tính hằng năm có hơn 160 triệu tấn H2SO4 được sản xuất ra để phục vụ các đơn vị công nghiệp này. Một báo cáo số chẳng hề nhỏ!
Trong phòng thí nghiệm
Được sử dụng trong việc điều chế những axit khác yếu hơn như: HNO3, HCL
Ứng dụng của H2SO4
Trong xử lý nước thải
H2SO4 là chất hóa học quan trọng dùng để điều chế Nhôm hidroxit một thành phần không thể thiếu khi xử lý nước trong các nhà máy. Nhôm hidroxit là hóa chất công nghiệp có vai trò lọc những tạp chất, khử mùi cho nước, cân bằng độ pH trong nước. Quan trọng nhất là dùng để loại bỏ những kim loại nặng trong nước như Mg, Ca, giúp hạn chế nguy cơ nước bị nhiễm phèn.
Trong sản xuất phân bón
Một ứng dụng cốt yếu của axit sunfuric ( H2SO4 ) là dùng làm phân bón. Đây là một trong những thành phần quan trọng nhất dùng để sản xuất những mẫu phân bón. Những loại phân bón được sản xuất bởi H2SO4 gồm: Phosphate, Canxi dihydrogen, Ammonium Phosphate, Amoni Sunfat…
Ứng dụng khác của dung dịch Axit sunfuric H2SO4
Sản xuất nhôm sunfat, được biết tới như là phèn làm giấy. Nó có thể phản ứng với 1 lượng nhỏ xà phòng trên những sợi bột giấy nhão để có thể tạo ra cacboxylat nhôm dạng gelatin, nó giúp làm cho các sợi bột giấy đông lại thành bề mặt cứng của giấy.
Bài tập vận dụng liên quan
Câu 1. Cho 6,5 gam Zn tác dụng với dung dịch H2SO4 loãng dư , thu được dung dịch X và khí H2 (đktc).
Tính thể tích khí H2 thu được thể tích là bao nhiêu?
- 2,24 lit
- 4,48 lít
- 3,36 lít
- 1,12 lít
Đáp án A
Số mol kẽm phản ứng:
nZn = m/M = 6,5/65 = 0,1 (mol)
Phương trình hóa học
Zn + H2SO4 → ZnSO4 + H2
0,1 → 0,1 → 0,1 (mol)
Thể tích khí H2 thu được là:
VH2 = nH2.22,4 = 0,1.22,4 = 2,24 (l)
Câu 2. Thả một mẫu kẽm vào dung dịch axit H2SO4 loãng thấy xuất hiện, hiện tượng gì?
- Có khí không màu thoát ra
- Có khí có màu thoát ra, và viên kẽm tan dần
- Có khí không màu thoát ra và mẩu kẽm tan dần
- Mẫu kẽm tan dần
Đáp án C
Chất rắn màu xám sẫm Kẽm (Zn) tan dần, thu được dung dịch trong suốt và có bọt khí thoát ra (H2)
Phương trình hóa học:
Zn + H2SO4 → ZnSO4 + H2↑
Câu 3. Cho m gam kẽm tác dụng với đ HCl dư thu được 2,24 lít khí H2 (đktc). Tính m?
- 6,5 gam
- 13 gam
- 8,7 gam
- 9,75 gam
Đáp án A
Ta có:
nH2 = 2,24/22,4 = 0,1 (mol)
Phương trình phản ứng xảy ra
Zn + 2HCl → ZnCl2 + H2
Theo phương trình phản ứng: nZn= nH2 = 0,1 (mol)
=> mZn = 0,1 . 65 = 6,5 g
Câu 4. X là một hợp chất của Zn thường được dùng trong y học, với tác dụng làm thuốc giảm đau dây thần kinh, chữa bệnh eczema, bệnh ngứa,…. Chất X là
- Zn(NO3)2.
- ZnSO4.
- ZnO.
- Zn(OH)2.
Đáp án C: ZnO được dùng trong y học, với tác dụng làm thuốc đau dây thần kinh, chữa bệnh eczema, bệnh ngứa,..do ZnO có tính chất làm săn da, sát khuẩn, bảo vệ, làm dịu tổn thương da,..
Câu 5. Cho dãy các chất: Cr(OH)3, Al2(SO4)3, Mg(OH)2, Zn(OH)2, MgO, CrO3. Số chất trong dãy có tính chất lưỡng tính là
- 5.
- 2.
- 3.
- 4.
Đáp án B: Số chất trong dãy có tính chất lưỡng tính là Cr(OH)3, Zn(OH)2
Câu 6. Các chất trong dãy nào sau đây vừa có tính oxi hóa vừa có tính khử?
- CrO3, FeO, CrCl3, Cu2O.
- Fe2O3, Cu2O, CrO, FeCl2.
- Fe2O3, Cu2O, Cr2O3, FeCl2.
- Fe3O4, Cu2O, CrO, FeCl2.
Đáp án D
Câu 7. Cho 2,24 gam bột Fe vào 200 ml dung dịch hỗn hợp gồm có AgNO3 0,1M và Cu(NO3)2 0,5M.
Khuấy đều tới phản ứng hoàn toàn, thu được chất rắn A và dung dịch B. Tính số gam chất rắn A.
- 4,08 gam
- 8,16 gam
- 2,04 gam
- 6,12 gam
Đáp án A
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag (1)
0,01 ← 0,02 → 0,01→ 0,02 (mol)
Fe + Cu(NO3)2 → Cu + Fe(NO3)2 (2)
0,03 ← 0,03 → 0,03 → 0,03 (mol)
nAgNO3= 0,02 (mol);
nFe = 0,04 (mol);
nCu(NO3)2 = 0,1(mol)
nFe phản ứng (1) = 0,01(mol); nFe pư (2) = 0,04 - 0,01 = 0,03 (mol)
nCu(NO3)2 dư = 0,1 - 0,03 = 0,07 (mol)
Chất rắn A gồm: 0,02 mol Ag và 0,03 mol Cu
⇒ mA = 0,02.108 + 0,03.64 = 4,08 (gam)
Câu 8. Cho 15,6 gam hỗn hợp Mg, Al tác dụng hết với dung dịch HCl dư sau phản ứng thấy khối lượng dung dịch tăng thêm 14 gam.
Tính số mol HCl đã tham gia phản ứng.
- 0,8 mol
- 0,4 mol
- 1,6 mol
- 0,25 mol
Đáp án C
Kim loại + HCl → muối + H2
Mg + 2HCl → MgCl2 + H2
2Al + 6HCl → 2AlCl3 + H2
Ta có: mdung dịch tăng = mkim loại - mkhí thoát ra
⇒ mH2 = 15,6 - 14 = 1,6 (gam) ⇒ nH2 = 0,8 (mol)
Áp dụng bảo toàn nguyên tử H: nHCl = 2.nH2 = 1,6 (mol).
Câu 9. Cho hỗn hợp A gồm Fe(NO3)2 và ZnO vào dung dịch H2SO4 loãng (dư) thu được dung dịch B.
Cho dung dịch KOH loãng (dư) vào B thu được kết tủa là
- Fe(OH)3 và Zn(OH)2.
- Fe(OH)3.
- Fe(OH)2 và Zn(OH)2.
- Fe(OH)2.
Đáp án B
3Fe2+ + 4H+ + NO3- → 3Fe3+ + NO + 2H2O
ZnO + 2H+ → Zn2+ + H2O
Fe3+ + 3OH- → Fe(OH)3 ↓
Zn2+ + 2OH- → Zn(OH)2 ↓
Zn(OH)2 ↓ + 2OH- → ZnO22- + 2H2O
Sau phản ứng chỉ thu được kết tủa là Fe(OH)3
Câu 10. Cho luồng khí C dư qua hỗn hợp các oxit CuO, Fe2O3, ZnO, MgO nung nóng ở nhiệt độ cao.
Sau phản ứng, hỗn hợp chất rắn còn lại là
- Cu, Fe, ZnO, MgO.
- Cu, Fe, Zn, Mg.
- Cu, Fe, Zn, MgO.
- Cu, FeO, ZnO, MgO.
Đáp án C chỉ khử được các oxit kim loại đứng sau Al => C khử được CuO, Fe2O3, ZnO và không khử được MgO
Câu 11. Cho a gam hỗn hợp bột Zn và Fe vào lượng dư dung dịch CuSO4.
Sau khi kết thúc các phản ứng, lọc bỏ phần dung dịch thu được m gam bột rắn. Thành phần phần trăm theo khối lượng của Zn trong hỗn hợp ban đầu là
- 12,67%.
- 85,30%.
- 90,27%.
- 82,20%.
Đáp án C
Gọi nZn = x mol; nFe = y mol
Zn + CuSO4 → ZnSO4 + Cu
x → x
Fe + CuSO4 → FeSO4 + Cu
y → y
nCu = x + y mol
Vì khối lượng chất rắn trước và sau phản ứng bằng nhau nên mZn + mFe = mCu
Do đó 65x + 56by = 64(x + y) ⇔ x = 8y
Vậy phần trăm khối lượng của Zn trong hỗn hợp ban đầu là
%mZn = (65x)/(65x + 56y).100 = 65.8y/(65.8y + 56y).100 = 90,27%
…………………………
Trên là thông tin về phản ứng Zn + H2SO4 là một trong những phản ứng hóa học quan trọng. Hiểu rõ phản ứng Zn + H2SO4 là cơ sở để nâng cao hiệu suất sản xuất và phát triển những công nghệ tiên tiến. Đồng thời, chúng ta cần cân nhắc và điều chỉnh quá trình này để đảm bảo an toàn, bảo vệ môi trường trong quá trình sử dụng.
Xem thêm:
- Fe3o4 H2so4 | Phương trình Fe3O4 + H2SO4 → Fe2(SO4)3 + SO2 + H2O
- Zn + H2SO4 đặc nóng | Zn + H2SO4 → ZnSO4 + SO2 + H2O
- Zn + HCl | Cân bằng phương trình Zn + HCl → ZnCl2 + H2
- So2 H2so4 | Phương trình hóa học SO2 + O2 + H2O → H2SO4
Link nội dung: https://khangdienreal.vn/h2so4zn-a60498.html